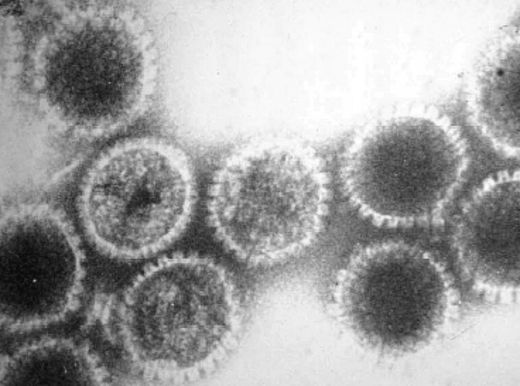
Lorsqu'il a infecté un organisme, le virus de l'herpès peut y rester toute sa vie, bien installé dans le noyau des neurones. Une équipe de recherche américaine vient de décrypter la stratégie développée par ce parasite pour atteindre rapidement le cerveau.
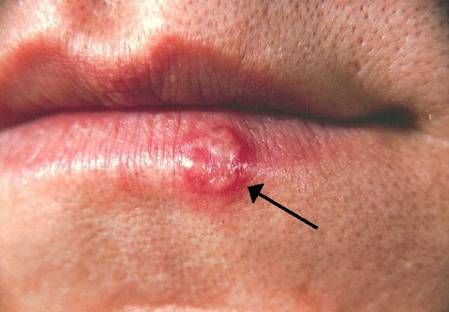
Le virus herpès simplex, ou HSV, est un virus contagieux qui touche de nombreuses personnes. En France, un tiers des adultes serait atteint, soit près de 17 millions de personnes. Ce virus provoque habituellement de légers symptômes comme des vésicules sur la bouche, le visage et les organes génitaux. Chez les personnes immunodéprimées, il peut également être responsable d'infections graves, voire mortelles, telles que des encéphalites.
Lorsqu'un individu est infecté par le virus, il l'est généralement toute sa vie. En effet, le virus peut facilement échapper au système immunitaire et persister de façon dormante dans les neurones.
Comment arrive-t-il dans le cerveau ? Des chercheurs américains de la Northwestern University Feinberg School à Chicago ont décrypté sa stratégie. Leurs travaux ont été publiés dans la revue Cell Host and Microbes.
Pour comprendre, il faut en revenir aux caractéristiques du virus de l'herpès. Il appartient à la famille des herpesviridés qui contiennent de l'ADN double brins.
Le HSV s'accroche aux microtubules
Pour que le cycle de multiplication virale ait lieu, le virus doit trouver le moyen de s'introduire dans le noyau des cellules. Et quoi de mieux que d'utiliser une porte d'entrée déjà mise en place par les cellules ? C'est en tout cas la tactique pour le moins ingénieuse qu'a mis au point le HSV.
Le squelette de nos cellules, ou cytosquelette, est composé de fibres appelées microtubules. Ils permettent d'acheminer divers éléments tels que des vésicules, des protéines et des organites à l'intérieur ou à l'extérieur du noyau. Ces microtubules sont particulièrement abondants dans les neurones. Le transport des composants cellulaires dans les microtubules est réalisé par des moteurs moléculaires appelés les dynéines. Ce sont des complexes protéiques qui s'associent aux microtubules et permettent le déplacement des vésicules. La vidéo ci-dessous schématise le fonctionnement de ces dynéines.
Les auteurs de cette étude ont démontré que le virus de l'herpès pouvait s'associer aux dynéines, par le biais de la protéine virale appelée VP1/2. Une fois attachées à ce moteur moléculaire, les particules virales sont directement projetées dans le noyau. Le virus détourne donc le fonctionnement de la cellule à son avantage : en s'attachant au moteur cellulaire, il peut rapidement infecter les cellules et parvenir jusqu'au cerveau. Selon Gregory Smith, directeur de ces travaux « cette astuce est la première du genre à être mise en évidence ».
Modélisation du fonctionnement des dynéines
Ces moteurs cellulaires se déplacent le long des microtubules (en gris)
et entraînent le transport des organites à l'intérieur de la cellule.
© Harvard Medical School, YouTube
Ce mécanisme viral pourrait être utilisé et copié en médecine régénérative. En effet, les chercheurs envisageraient de se servir du virus de l'herpès comme outil pour insérer des gènes dans les cellules nerveuses. Bien que des études soient encore nécessaires, cette technologie serait susceptible de faire avancer la recherche de traitements contre les maladies neurodégénératives telles qu'Alzheimer ou Parkinson.



Commentaires des Lecteurs
Lettre d'Information