C'est après la validation de cette phase 3 que l'autorisation de mise sur le marché (AMM) peut-être donnée au laboratoire.
On est donc dans un essai clinique sauvage imposé à toute la population par la peur et le chantage, l'extorsion de consentement. C'est tout simplement CRIMINEL !
Comme tout médicament, les vaccins contre la Covid-19 ne peuvent pas être commercialisés sans autorisation de mise sur le marché.
Comment les laboratoires obtiennent-ils ce précieux sésame ? Décryptage.
Covid-19 ou pas, la décision d'autoriser ou non un vaccin ne relève pas du Gouvernement, mais appartient aux autorités scientifiques indépendantes qui sont en charge de l'évaluation des produits de santé.
En Europe, c'est l'Agence européenne des médicaments (EMA) qui organise l'évaluation des vaccins contre la Covid-19, en s'appuyant sur l'expertise des 27 agences nationales. En France, il s'agit de l'Agence nationale de sécurité du médicament (ANSM).
Avant de détailler la procédure d'autorisation d'un vaccin contre la Covid-19, penchons-nous d'abord sur les différentes étapes d'élaboration du vaccin lui-même...
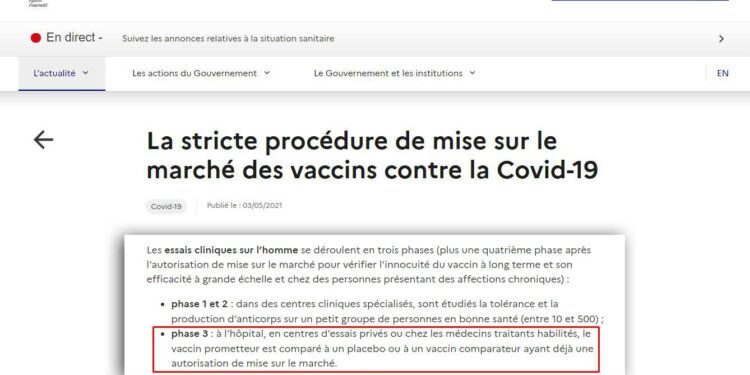
Les essais cliniques sur l'homme se déroulent en trois phases (plus une quatrième phase après l'autorisation de mise sur le marché pour vérifier l'innocuité du vaccin à long terme et son efficacité à grande échelle et chez des personnes présentant des affections chroniques) :
- phase 1 et 2 : dans des centres cliniques spécialisés, sont étudiés la tolérance et la production d'anticorps sur un petit groupe de personnes en bonne santé (entre 10 et 500) ;
- phase 3 : à l'hôpital, en centres d'essais privés ou chez les médecins traitants habilités, le vaccin prometteur est comparé à un placebo ou à un vaccin comparateur ayant déjà une autorisation de mise sur le marché.

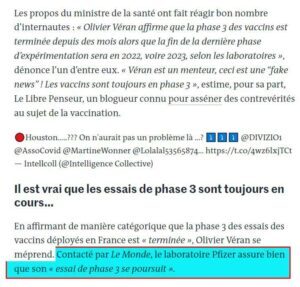



vaccininjection est sans danger et parfaitement efficace".