OF THE
TIMES
Tous les dix ans environ, les États-Unis doivent attraper un petit petit pays minable et le jeter contre le mur, juste pour montrer au monde que nous sommes sérieux.
Diminution vitesse de rotation du globe terrestre couplé aux apprentis sorciers de cette civilisation, déstabilisation croute terrestre ,...
Ça et aussi les charniers découverts à l'hôpital Nasser de gaza me dépriment....Le monde est écoeurant. Tout donne envie de tuer les responsables,...
Le jour ou les Palestiniens en ont eu vraiment marre, ils sont allés dans le désert, à une rave party :)
Pour ceux qui ne la connaissent pas : On a demandé à un penseur : "Que pensez-vous des progrès de l'intelligence artificielle ? Êtes-vous...
Voyez, ouvrez bien les yeux et votre esprit . Tout est montré et tout est clair . Réagissez, même si cela semble difficile ou impossible . Bientôt...
To submit an article for publication, see our Submission Guidelines
Les commentaires des lecteurs ne réflètent pas nécessairement l'opinion des bénévoles, contributeurs et responsables de Sott.net ou du Quantum Future Group
Certaines des icônes apparaissant sur ce site proviennent de : Afterglow, Aha-Soft, AntialiasFactory, artdesigner.lv, Artura, DailyOverview, Everaldo, GraphicsFuel, IconFactory, Iconka, IconShock, Icons-Land, i-love-icons, KDE-look.org, Klukeart, mugenb16, Map Icons Collection, PetshopBoxStudio, VisualPharm, wbeiruti, WebIconset
Powered by PikaJS 🐁 and In·Site
Contenu original © 2002-2024 par Sott.net/Signs of the Times. Voir : Clause d'utilisation équitable
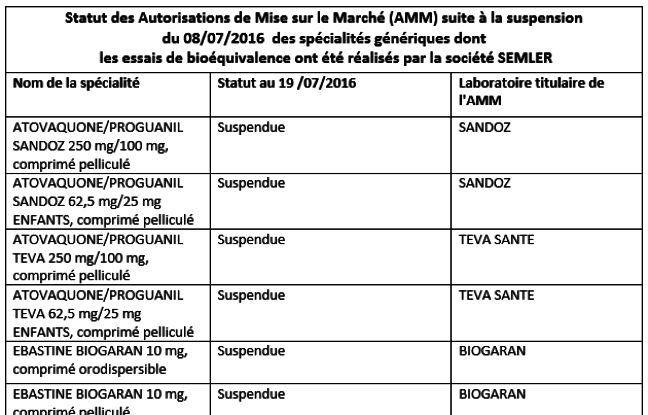
Commentaire : Vous pouvez lire aussi :