Commentaire : « Actif ou inactif, allumé ou éteint, exprimé ou réprimé : différents champs sémantiques sont couramment utilisés pour définir l'état d'un gène. Ils font tous référence au même phénomène : un gène est un segment d'ADN qui contient l'information nécessaire à la synthèse d'une ou de plusieurs molécule(s) qui constitue(nt) l'organisme. Le gène est dit actif/allumé/exprimé lorsque cette synthèse a lieu. Sinon, il est inactif/éteint/réprimé. Mais évidemment, l'expression génétique n'est pas un processus fait de noir et blanc : il existe plein de niveau gris, avec par exemple des gènes très actifs, surexprimés (synthèse importante) ou encore partiellement réprimés (synthèse très faible)... »
Source : Inserm

Parmi ceux qui ont survécu, beaucoup ont été marqués à vie par les douloureuses expériences. Ils ont ensuite réintégré la société avec une santé déficiente, de moins bonnes perspectives d'emploi et une espérance de vie plus courte. Mais l'impact de ces difficultés ne s'est pas arrêté à ceux qui en ont fait l'expérience. Elle a également eu des conséquences sur les enfants et les petits-enfants de ces prisonniers, et ces conséquences semblent avoir été transmises à la lignée masculine des familles.
Bien que leurs fils et petits-fils n'aient pas souffert des épreuves des camps de prisonniers de guerre — et quand bien même ils aient bénéficié de bons soins pendant leur enfance — ils ont été affectés par des taux de mortalité plus élevés que la population générale. Il s'est avéré que les prisonniers de guerre avaient transmis une partie de leur traumatisme à leur progéniture.
Mais contrairement à la plupart des maladies dites héréditaires, cette transmission ne s'est pas effectuée par des altérations dans le code génétique, et ce n'est donc pas là qu'il fallait rechercher l'origine de ce phénomène. Au lieu de cela, les chercheurs se sont penchés sur un type d'héritage beaucoup plus nébuleux, ou comment les événements de la vie d'une personne peuvent changer la façon dont son ADN est exprimé, et comment ce changement peut être transmis à la génération suivante.
C'est le processus de l'épigénétique, lors de laquelle la lisibilité — ou expression — des gènes est modifiée sans changer le code ADN lui-même. De minuscules marqueurs chimiques sont ajoutés ou retirés de notre ADN en réponse aux changements de l'environnement dans lequel nous évoluons. Ces marqueurs activent ou désactivent les gènes, ce qui permet de s'adapter à des conditions changeantes sans provoquer un changement plus permanent dans nos génomes.

Pour les prisonniers de guerre des camps confédérés, ces changements épigénétiques étaient le résultat d'une surpopulation extrême, d'un mauvais assainissement et de malnutrition. Les hommes devaient survivre avec de petites rations de maïs, et beaucoup moururent de diarrhée et de scorbut.
« Cette période a été marquée par une intense famine », explique l'auteure de l'étude Dora Costa, économiste à l'Université de Californie, Los Angeles. « Les hommes étaient réduits à des squelettes ambulants ».
Costa et ses collègues ont étudié les dossiers médicaux de près de 4 600 enfants dont les pères avaient été prisonniers de guerre, les comparant à un peu plus de 15 300 enfants d'anciens combattants qui n'avaient pas été capturés.
Le taux de mortalité des fils de prisonniers de guerre était de onze pour cent plus élevé que celui des fils d'anciens combattants qui n'avaient pas été faits prisonniers. D'autres facteurs tels que le statut socio-économique du père ainsi que l'emploi et l'état matrimonial du fils ne pouvaient pas, selon les chercheurs, expliquer le taux de mortalité plus élevé.
Cette surmortalité étaient principalement due à des taux plus élevés d'hémorragies cérébrales. Les fils de vétérans faits prisonniers de guerre étaient par ailleurs légèrement plus susceptibles de mourir d'un cancer. En revanche, les filles d'anciens prisonniers de guerre se sont révélées être immunisées contre ces effets.
Cette inhabituelle tendance liée au sexe est l'une des raisons qui ont poussé Costa à soupçonner que ces disparités physiologiques étaient dues à des changements épigénétiques. Mais Costa et son équipe ont d'abord dû exclure la possibilité d'un effet génétique :
« Ce que l'on peut avancer, c'est qu'un trait génétique qui a permis au père de survivre au camp — une tendance à l'obésité par exemple — s'est ensuite révélée néfaste hors du contexte initial. Cependant, en examinant tous les membres de ces familles, les effets ne sont visibles que chez les fils nés après la guerre, mais pas pour ceux qui sont nés avant. »Si l'on pouvait imputer la cause à un caractère génétique, les enfants nés avant et après la guerre seraient tout aussi susceptibles de présenter une espérance de vie réduite. Puisque la cause génétique a pu être exclue, l'effet épigénétique constituait l'explication la plus plausible.

Mais que se passerait-il si ce risque accru de décès était dû à un héritage du traumatisme du père qui n'aurait rien à voir avec l'ADN ? Que se passerait-il si les pères traumatisés étaient plus susceptibles de maltraiter leurs enfants, ce qui aurait des conséquences à long terme sur leur santé, et si leurs fils en portaient le poids plus que leurs filles ?
Une fois de plus, la comparaison de l'état de santé des enfants au sein des familles a permis d'écarter cette possibilité. Les enfants nés d'hommes avant que ces derniers ne soient faits prisonniers de guerre n'ont pas connu une hausse de la mortalité. C'est par contre le cas pour les fils nés des mêmes hommes après leur expérience dans un camp de prisonniers de guerre. Costa explique :
« Il s'agit d'écarter les autres options possibles. C'est en grande partie en recherchant la preuve par élimination et en tentant de découvrir quelle est l'explication la plus cohérente. »Si l'on considère en général que les traumatismes se sont répercutés sur les générations suivantes par le biais de l'épigénétique chez les humains, on imagine la plupart du temps que ces traumatismes sont liés aux moments les plus sombres de l'histoire. Les guerres, les famines et les génocides auraient tous laissé une marque épigénétique sur les descendants de ceux qui en ont souffert.
Certaines études se sont révélées plus controversées que d'autres. Une étude réalisée en 2015 a révélé que les enfants des survivants de l'Holocauste présentaient des modifications épigénétiques à un gène lié à leur taux de cortisol, une hormone impliquée dans la réponse au stress.
Rachel Yehuda, directrice de la Division des études sur le stress traumatique de l'École de médecine du Mount Sinaï et auteur de l'étude explique :
« Le concept de découverte d'un code messager à travers l'épigénétique chez les enfants de survivants de traumatismes peut signifier beaucoup de choses. Qu'il soit présent s'avère stimulant. »L'étude était de petite envergure, évaluant seulement trente-deux survivants de l'Holocauste et un total de vingt-deux de leurs enfants, avec un petit groupe témoin. Certains scientifiques ont par ailleurs critiqué les conclusions de l'étude. Sans un examen sur plusieurs générations et une recherche plus large dans le génome, nous ne pouvons pas vraiment avoir la certitude de l'implication d'un héritage épigénétique, dans ce cas-là.
Yehuda reconnaît que l'article a été exagéré à travers certaines descriptions et qu'il faudrait mener des études plus vastes sur plusieurs générations pour en tirer des conclusions plus probantes. Il explique :
« Ce n'était qu'une seule petite étude à travers un échantillon représentatif d'adultes menée de nombreuses années après le traumatisme parental. Avoir découvert un indice en direction de l'épigénétique était une grande nouvelle en soi. La question est aujourd'hui de savoir comment développer l'idée de base en lui conférant de plus amples précisions pour la rendre exhaustive. Quelle est notre réelle compréhension du processus impliqué ? »Des expériences contrôlées chez la souris ont permis aux scientifiques de se pencher sur cette question. Une étude réalisée en 2013 a révélé qu'il existait un effet intergénérationnel de traumatisme associé à l'odeur. Les chercheurs ont soufflé de l'acétophénone — qui a l'odeur de la fleur de cerisier — à travers les cages des souris mâles adultes tout en envoyant sur leurs pattes un choc électrique. Au cours de plusieurs répétitions, les souris ont finalement associé l'odeur de la fleur de cerisier à la douleur.

Les bébés souris nés des petits de ces mâles traumatisés ont à leur tour montré une sensibilité accrue à l'odeur. Aucune des générations n'a montré une plus grande sensibilité aux odeurs autres que la fleur de cerisier, ce qui indique que la transmission était spécifique à cette odeur.
Cette sensibilité à l'odeur de fleur de cerisier a pu être corrélée à des modifications épigénétiques dans l'ADN de leur sperme. Des marqueurs chimiques dans leur ADN ont été trouvé sur un gène codant pour un récepteur olfactif, exprimé dans le bulbe olfactif entre le nez et le cerveau, lequel est impliqué dans la détection du parfum de la fleur de cerisier. Lorsque l'équipe a disséqué le cerveau des petits, elle a également découvert qu'il y avait un plus grand nombre de neurones en mesure de détecter l'odeur de fleur de cerisier, comparativement aux souris témoins.
La deuxième et la troisième génération ne semblaient pas avoir peur de l'odeur en tant que telle, mais avaient développé une sensibilité accrue à celle-ci. Cette découverte met en lumière une subtilité souvent négligée de la transmission épigénétique, à savoir que la génération suivante ne présente pas toujours exactement les mêmes caractéristiques que celles développées par ses parents. Ce n'est pas tant que la peur se transmet de génération en génération — c'est plutôt que la peur d'une odeur pour une génération donnée entraîne une sensibilité à la même odeur pour la suivante.
« Ce ne sont donc pas deux choses identiques que l'on puisse vraiment comparer », explique Brian Dias, auteur de l'étude et chercheur à l'université Emory et au Yerkes National Primate Research Center, aux États-Unis. Même le terme « hérédité » devrait être nuancé dans ce cas de figure, ajoute-t-il. « La notion d'hérédité suggère une représentation fidèle d'un trait de caractère qui se transmet. »
Commentaire : La transmission générationnelle des caractères acquis par l'épigénétique se révèle par ailleurs en contradiction avec la théorie de l'évolution de Darwin.
« Il a longtemps été considéré que le rôle des gènes et de la génétique était figé, immuable et indépendant de l'influence des évènements de la vie. Depuis quelques années, la notion de caractère immuable et déterministe de la transmission génétique est mise à mal par les nombreuses découvertes faites dans le domaine de la biologie et de la génétique. »
Source : Cairn.info
Même si elles sont subtilement modifiées d'une génération à l'autre, les conséquences d'une transmission des traumatismes sont potentiellement colossales. Notre façon d'appréhender notre vie dans le contexte de l'expérience de nos parents — influençant notre physiologie et même notre santé mentale — en serait complètement modifiée.
Et le fait de savoir que les conséquences de nos propres actions et expériences actuelles pourraient affecter la vie de nos enfants — bien avant même qu'ils aient été conçus — pourrait donner une toute autre tournure à nos choix de vie.
Malgré ces échos de traumatismes qui ont traversé les générations, la recherche sur la transmission épigénétique constitue une pierre d'achoppement : personne n'est sûr de la façon dont cela se produit. Certains scientifiques pensent qu'il s'agit en fait d'un événement très rare.
L'une des raisons pour lesquelles cette recherche n'est peut-être pas assez répandue est que la grande majorité d'un type de marqueur épigénétique dans l'ADN — visualisé en laboratoire par l'ajout d'un groupe de produits chimiques appelé méthylation — est effacée au tout début de la vie et le processus d'ajout de ces groupes chimiques à l'ADN commence presque comme s'il n'y avait jamais rien eu.
Anne Ferguson-Smith, une scientifique étudiant l'épigénétique à l'université de Cambridge explique :
« Dès que les spermatozoïdes pénètrent dans l'ovule d'un mammifère, il y a une perte rapide de méthylation de l'ADN dans l'ensemble des chromosomes paternels. C'est la raison pour laquelle l'héritage épigénétique transgénérationnel est une telle surprise. Il est très difficile d'imaginer que l'on puisse disposer d'une transmission épigénétique lorsqu'il existe un processus d'élimination de toutes les marques épigénétiques qui transmettrait tout de même de nouvelles marques dans la génération suivante. »Il y a cependant des parties du génome qui ne sont pas effacées. Un processus appelé empreinte génomique protège la méthylation à des points spécifiques du génome. Mais ces sites ne sont pas ceux où se trouvent les changements épigénétiques pertinents avec le traumatisme en question.
Une récente étude du groupe de Ferguson-Smith suggère que l'hérédité épigénétique est probablement très rare chez la souris.
Mais d'autres chercheurs sont convaincus qu'ils ont trouvé les caractéristiques de la transmission épigénétique pour plusieurs traits distinctifs — aussi bien chez les humains que chez les animaux. De plus, ils pensent avoir trouvé un mécanisme de son fonctionnement. Cette fois-ci, ce pourraient être des molécules similaires à l'ADN — connues sous le nom d'ARN — qui modifieraient le fonctionnement des gènes.
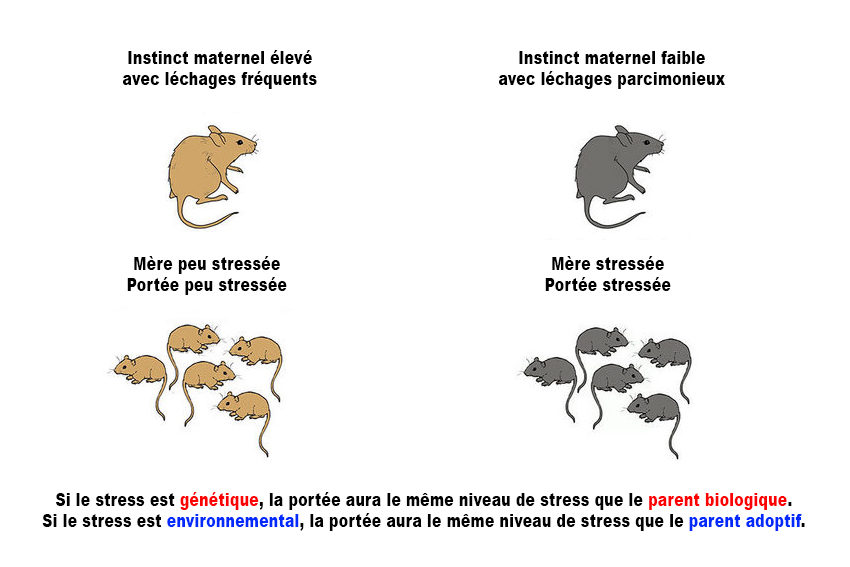
Isabelle Mansuy de l'université de Zurich et de l'EPFZ, qui a dirigé la recherche, déclare :
« Notre modèle est tout à fait unique. Il a été créé pour imiter les familles disloquées, ou les abus, négligence et dommages émotionnels que l'on rencontre parfois chez certaines personnes. »Les symptômes que ces petites souris présentaient en grandissant imitaient également ceux observés chez les enfants qui ont subi un traumatisme précoce. Les souris présentaient des signes d'augmentation de la prise de risque et de l'apport calorique, deux signes observés chez les enfants ayant survécu à un traumatisme. Lorsque les mâles grandissaient, ils avaient des petits qui présentaient des caractéristiques similaires — suralimentation, prise de risques et comportement antisocial plus marqué.
Les chercheurs ont extrait des molécules d'ARN du sperme de souris mâles qui avaient été traumatisées et ont injecté ces molécules dans les embryons de souris dont les parents n'avaient pas vécu de traumatisme précoce. Les petites souris issus de ces embryons ont bien montré des schémas comportementaux typiques d'un bébé souris dont les parents ont subi un traumatisme.
Les scientifiques ont également découvert que différentes longueurs de molécules d'ARN étaient liées à différents modèles comportementaux : des ARN plus longs correspondaient à une plus grande consommation d'aliments, modifiaient la réponse de l'organisme à l'insuline et augmentaient la prise de risques. De plus petites molécules d'ARN étaient liées à des signes de désespoir. Mansuy déclare :
« C'est la toute première fois que nous sommes en mesure d'observer ce lien de causalité. »Nous ne savons pas encore comment ces molécules d'ARN modifient le comportement sur plusieurs générations. Mansuy mène actuellement des expériences chez l'être humain pour voir si des processus similaires sont à l'œuvre. Les premières expériences menées par d'autres chercheurs ont montré que cela semble être effectivement le cas chez les hommes.
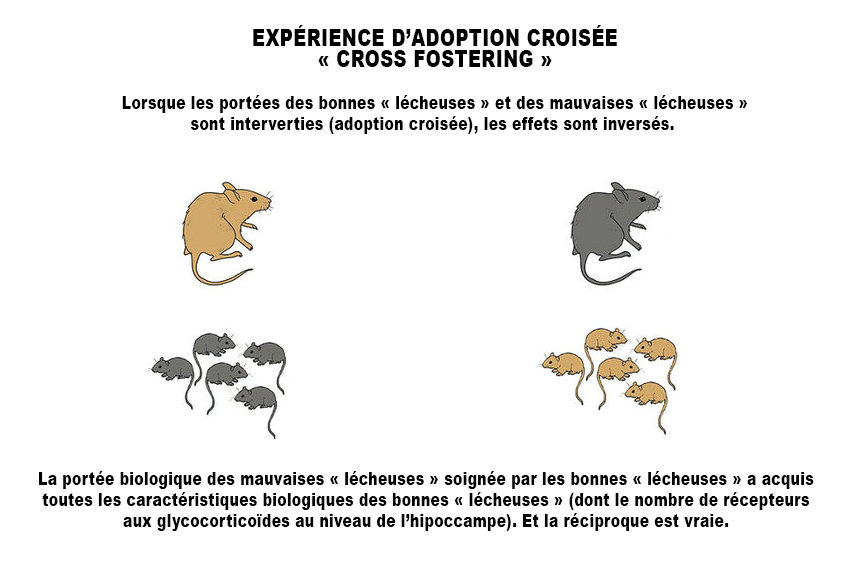
Cependant, les efforts pour déchiffrer l'héritage épigénétique chez les femelles constituent l'étape suivante. Mansuy explique :
« Il fallait bien commencer quelque part, mais nous ambitionnons d'établir un modèle de traumatisme qui indique comment l'héritage se transmet à la fois par les femelles et les mâles. »Il existe d'autres types connus de processus épigénétiques qui sont relativement peu étudiés. L'un d'entre eux est appelée la modification des histones, où les protéines qui servent de support à l'ADN sont marquées chimiquement. Aujourd'hui, la recherche commence à suggérer que chez les mammifères, les histones pourraient également être impliquées dans la transmission épigénétique à travers les générations. Dias explique :
« Je soupçonne que la réponse réside dans le fait que tous ces processus pourraient interagir et révéler le phénomène à la source de la transmission intergénérationnelle des traits acquis. »
Commentaire : « Nos 46 chromosomes représentent 2 mètres d'ADN ! Comment les faire tenir dans le noyau d'une cellule qui mesure 10 à 100 µm de diamètre ? La solution est le compactage : la molécule d'ADN s'enroule d'abord régulièrement autour de complexes formés par des protéines nommées histones. Les structures ainsi constituées, les nucléosomes s'enroulent ensuite sur elles-mêmes de manière plus ou moins « serrée », formant ainsi des fibres de chromatine plus ou moins denses. Lorsque la chromatine est très dense (hétérochromatine, compactage élevé de l'ADN), les gènes ne sont pas accessibles et donc pas exprimés. Les zones de la chromatine peu condensée (euchromatine) sont en revanche accessibles aux complexes enzymatiques qui permettent l'expression des gènes. Des modifications épigénétiques qui affectent les histones permettent à la chromatine de passer de l'un à l'autre de ces états. »
Source : Inserm
La science des conséquences épigénétiques des traumatismes est récente, ce qui signifie qu'elle suscite encore de vifs débats. Pour Yehuda, qui a fait œuvre de pionnier dans le domaine du syndrome de stress post-traumatique dans les années 1990, cette science s'accompagne d'un sentiment de déjà vu. Dias poursuit :
« L'état actuel de l'épigénétique est semblable à ce qu'il était lorsque nous avons commencé à faire de la recherche sur le trouble de stress post-traumatique. C'était un diagnostic controversé, car tout le monde ne pensait pas qu'un effet à long terme d'un traumatisme pouvait exister. »Près de trente ans plus tard, le trouble de stress post-traumatique est une pathologie médicalement reconnue qui explique pourquoi la transmission d'un traumatisme peut s'étendre sur plusieurs décennies dans la vie d'une personne.
Mais s'il est démontré que le traumatisme se transmet de génération en génération chez l'homme de la même manière qu'il semble le faire chez la souris, nous ne devrions alors plus ressentir un sentiment d'inéluctabilité face à cet héritage, selon Dias.
À l'aide de ses expériences menées avec les fleurs de cerisier chez la souris, le scientifique a procédé à des tests permettant d'examiner a posteriori les implications d'une désensibilisation à l'odeur de fleur de cerisier chez les mâles conditionnés pour la craindre. Les souris ont alors été exposées à plusieurs reprises à la même odeur sans recevoir de choc électrique aux pieds :
« La souris n'a pas oublié, mais une nouvelle association est en train de se former maintenant que cette odeur n'est plus associée à la douleur du choc électrique. »Lorsque le chercheur a observé leur sperme après le processus de désensibilisation, les souris mâles avaient perdu leur signature épigénétique « craintive » symptomatique. Les petits de ces souris ne présentaient pas non plus de sensibilité accrue à l'odeur de fleur de cerisier. Ainsi, si une souris « désapprend » l'association d'une odeur et d'une douleur, la génération suivante peut alors échapper aux effets subséquents.
Ces résultats suggèrent également que si les humains héritent de manière similaire d'un traumatisme, l'effet sur notre ADN pourrait être annulé par des techniques comme la thérapie comportementales et cognitive. Dias explique :
« Il existe une malléabilité dans le système. Le sort n'en est pas jeté. En tant que race humaine dans son ensemble nous pouvons pour la plupart remédier à cette transmission générationnelle, même si les traumatismes abondent dans notre environnement. »Dans certains cas, du moins, explique M. Dias, la guérison des effets des traumatismes intergénérationnels au cours de notre vie peut y mettre un terme en faisant écho d'une génération à l'autre.
Source de l'article : BBC
Traduction : Sott.net




Commentaire : Il est réconfortant de lire un article sur l'héritage épigénétique d'un traumatisme se terminer sur une note d'espoir. Le déterminisme génétique est un concept dépassé, bien qu'il soit toujours vanté dans une grande partie de la presse grand public (et même dans les milieux universitaires). Il est important de réaliser que nous sommes plus que la somme de nos gènes et que les problèmes qui sont les nôtres, qu'ils soient appris ou hérités, peuvent être résolus.
Pour ce qui concerne plus spécifiquement les enjeux de l'épigénétique relatifs à la santé et aux maladies : Et pour aller plus loin :